Zellseparation aus Blut
Die Anreicherung von Zellen und die Optimierung von Zellseparationsmethoden spielt für viele Forscher eine entscheidende Rolle. Es existieren verschiedene Ansätze zur Sortierung unterschiedlicher Zelltypen, wobei die Wahl der geeigneten Methode oft vom jeweiligen Zelltyp oder der Zelluntergruppe abhängt. Eine der schnelleren und kostengünstigeren Methoden zur Trennung von Zellen ist die Dichtegradientenzentrifugation. In unsrem Artikel: "Zellseparation und Zellseparationsmethoden" haben wir die verschiedenen Möglichkeiten zur Anreicherung von Zellen zusammengestellt.
Dichte von Zellen als Hilfsmittel für die Zellseparation
Basierend auf der unterschiedlichen Dichte der einzelnen Blutbestandteile können diese durch eine einstufige Zentrifugation mit dem entsprechenden Dichtegradientenmedium getrennt werden. Die Technik basiert auf der Tatsache, dass während der Zentrifugation Partikel mit unterschiedlicher Dichte unterschiedliche Sedimentationsraten aufweisen. Schwere Partikel wie Erythrozyten sedimentieren schnell, während leichtere Zellen wie Thrombozyten langsamer sedimentieren. Die folgende Abbildung zeigt die Verteilung der wichtigsten Zellpopulationen von Blut. Erythrozyten haben die größte Dichte und Thrombozyten die geringste Dichte.
Verteilung von Blutzellen in Abhängigkeit von der Dichte
Die folgende Abbildung zeigt die Verteilung von Blutzellen in Abhängigkeit von deren Dichte. Thrombozyten (1) haben die geringste Dichte, Erythrozyten (2) die höchste Dichte. Zudem ist die Anzahl der Zellen pro Population dargestellt. Erythrozyten stellen die größte Population, Thrombozyten die zweitgrößte Population dar.
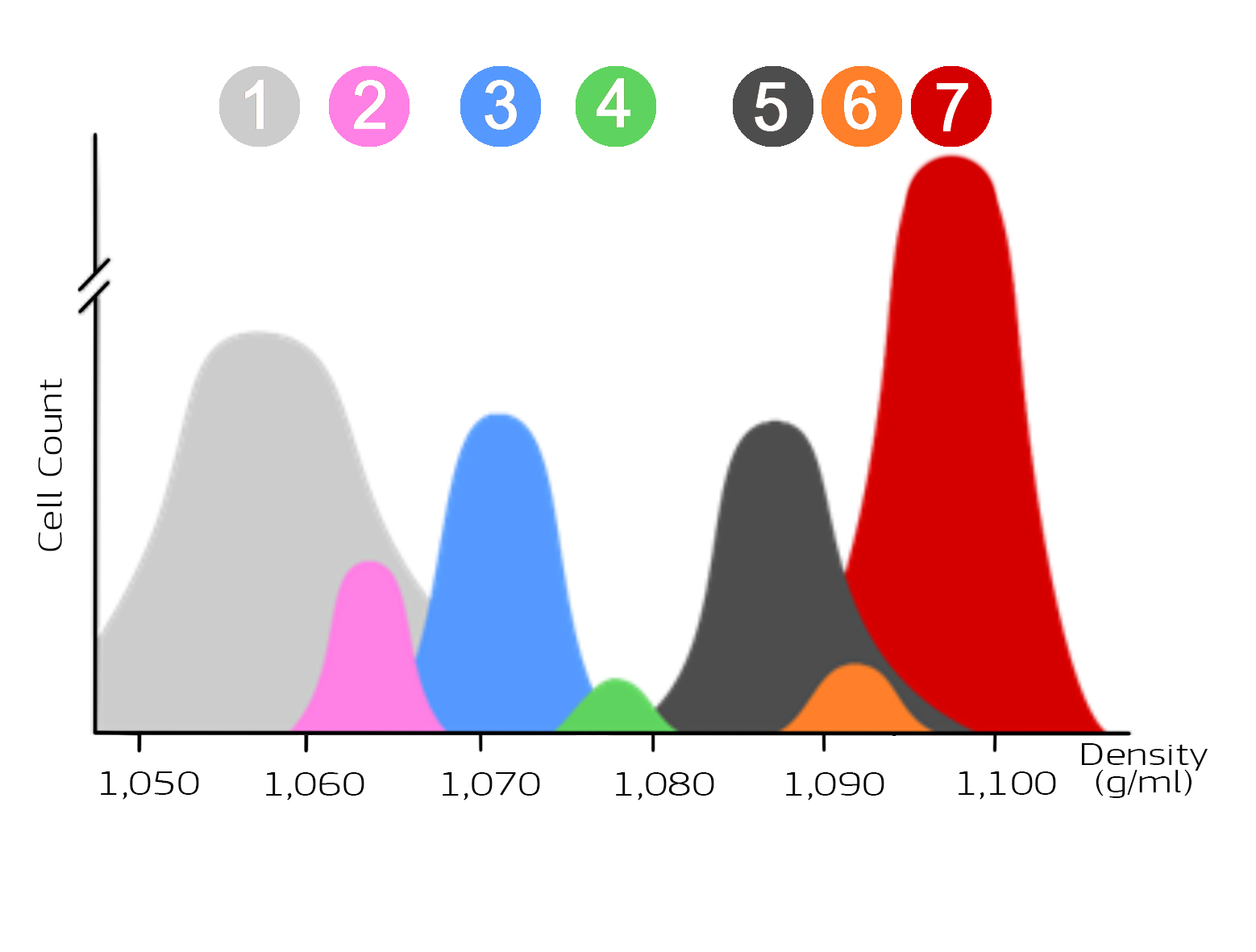
Abbildung 1: Darstellung der Zellpopulationen von Blut in Abhängigkeit von der Dichte
Die Zellpopulationen Thrombozyten (1), Monozyten (2), Lymphozyten (3), Basophilen Granulozyten (4), Neutrophilen Granulozyten (5), Eosinophilen Granulozyten (6) und Erythrozyten (7) unterscheiden sich in der Dichte sowie der Zellzahl. Die unterschiedliche Dichte der Zellpopulationen wird für die Anreicherung mit Hilfe von Dichtegradientenmedien verwendet.
Tabelle: Dichtebereiche von Blutzellen
Type | Blodcelle | Tæthed (g/ml) |
1 | Trombocytter | 1,050 - 1,070 |
2 | Monocytter | 1,060 - 1,068 |
3 | Lymfocytter | 1,067 - 1,077 |
4 | Basofile granulocytter | 1,072 - 1,081 |
5 | Neutrofil granulocyt | 1,079 - 1,098 |
6 | Eosinofile granulocytter | 1,089 - 1,095 |
7 | Erytrocytter | 1.090 - > 1.100 |
Type | Blodcelle | Tæthed (g/ml) |
1 | Trombocytter | 1,050 - 1,070 |
2 | Monocytter | 1,060 - 1,068 |
3 | Lymfocytter | 1,067 - 1,077 |
4 | Basofile granulocytter | 1,072 - 1,081 |
5 | Neutrophile | 1,079 - 1,098 |
6 | Eosinofile granulocytter | 1,089 - 1,095 |
7 | Erytrocytter | 1.090 - > 1.100 |
Wie man aus der Abbildung und der Tabelle sehen kann, ist die Dichte der Zellen bzw. Zellpopulationen eine Verteilung um einen Mittelwert. Zudem überschneiden sich die Dichten der unterschiedlichen Zellpopulationen. Der Bereich als auch die Verteilung um den Mittelwert sind keinen festen Größen. Schwankungen in der Dichte kann durch verschiedene Faktoren beeinflusst werden. Ein wichtigster Einflussfaktoren auf die Dichte der Zellen ist die Hydratisierung der Zellen. Ein weiterer wichtiger Einflussfaktor auf die Dichte der Vollblutzellen, ist die Zeit außerhalb des Spenderorganismus.
Verwendung von Dichte-Gradienten-Medien für die Dichte-Gradienten-Zentrifugation
Mit dem Wissen um die Dichte von Blutzellen ist es möglich, verschiedene Zellpopulationen gezielt anzureichern. Dabei kommen Dichte-Gradienten-Medien zum Einsatz – Lösungen mit einer definierten Dichte. Diese Dichte bestimmt die Trenngrenze (Cut-off). Zellen mit einer geringeren Dichte als der Cut-off sammeln sich als Schicht oberhalb des Mediums, während Zellen mit einer höheren Dichte das Trennmedium passieren und sich am Boden des Röhrchens absetzen. Die folgende Abbildung zeigt ein typisches Bild für die Trennung von Vollblut mit einem Trennmedium zur Anreicherung von periphere mononukleäre Blutzellen - kurz PBMC.
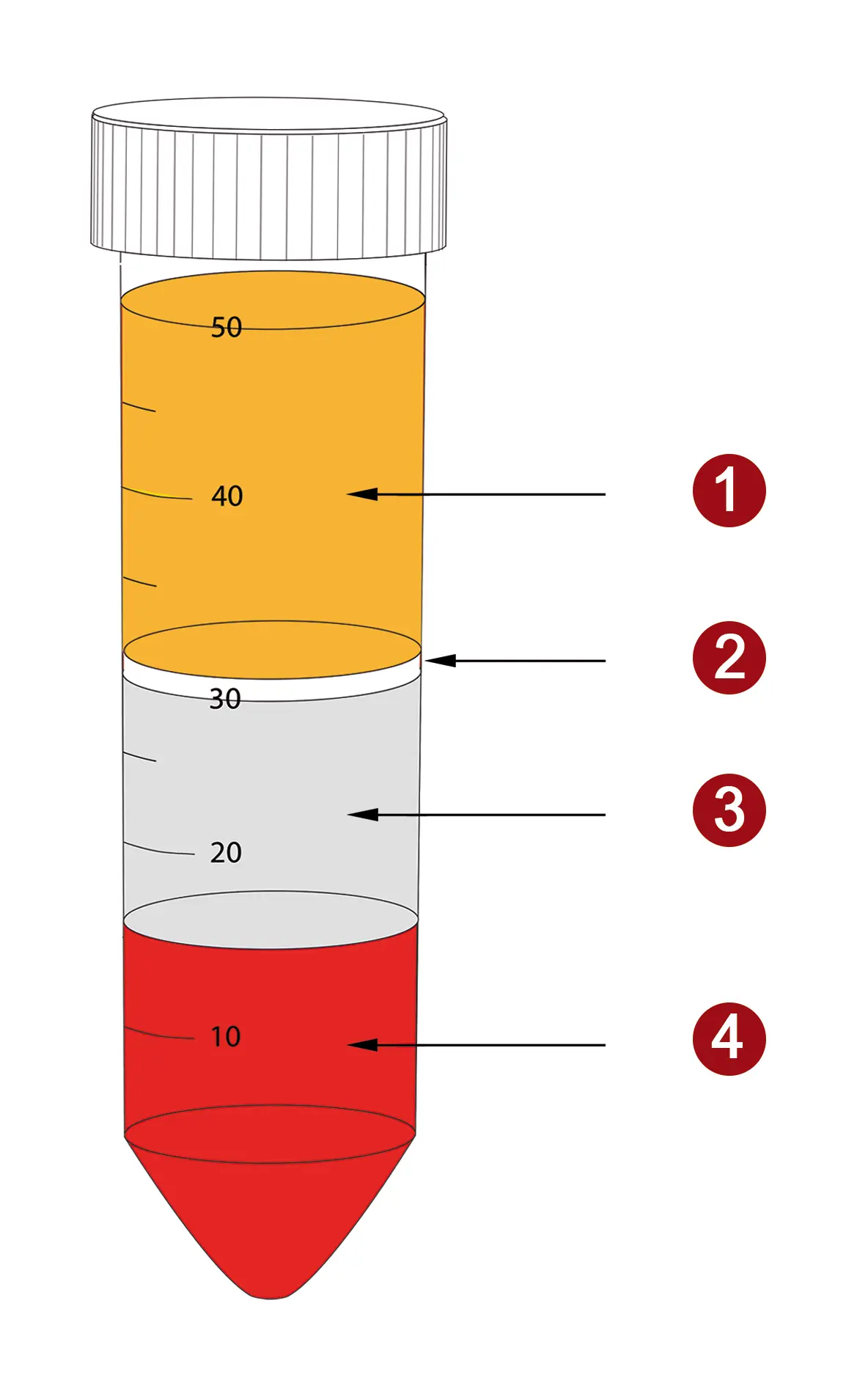
Abbildung 2: Verteilung der Schichten nach einer Dichte-Gradienten-Zentrifugation von Vollblut mit PBMC Spin Medium. PBMC (2) sammeln sich zwischen Plasma (1) und Dichtemedium (3). Erythrozyten, Granulozyten und tote Zellen passieren das Medium und werden am Boden des Röhrchens (4) konzentriert.
Dichtemedien für verschiedene Zellpopulationen
PBMC Spin Medium, Dichtegradientenmedium

sterile, gebrauchsfertige Lösung zur in vitro Isolation humaner PBMC aus frischem Probenmaterial
PBMC 24+ Spin Medium, Dichtegradientenmedium

sterile, gebrauchsfertige Lösung zur in vitro Isolation humaner PBMC aus mehr als 12 Stunden altem Probenmaterial
Leuko Spin Medium, Dichtegradientenmedium

sterile, gebrauchsfertige Lösung zur in vitro Isolation aller Leukozyten aus frischen humanem Probenmaterial
Leuko 24+ Spin Medium, Dichtegradientenmedium

sterile, gebrauchsfertige Lösung für die in vitro Isolation aller Leukozyten aus mehr als 12h altem humanem Probenmaterial
Monocyte Spin Medium, Dichtegradientenmedium

sterile, gebrauchsfertige Lösung zur in vitro Isolation humaner Monozyten aus frischem Probenmaterial
PLT Spin Medium, Dichtegradientenmedium

sterile, gebrauchsfertige Lösung zur in vitro Isolation humaner Thrombozyten (Platelets, kurz PLT) aus frischem Probenmaterial